三阴性乳腺癌新利器,首个抗体偶联药物(ADC)获批在即
发布时间:2020-07-07 10:52:31 访问次数:
近日,Immunomedics公司宣布,其抗体偶联药物(ADC)sacituzumab govitecan,因在III期临床试验(ASCENT)中表现出了显著的疗效,而将提前终止试验。值得一提的是,该药是治疗转移性三阴性乳腺癌(mTNBC)的首个靶向TROP-2的抗体药。
抗体偶联药物(ADC)是通过特定连接子(Linker),将单克隆抗体药物和小分子细胞毒药物连接而成的组合药物。由于它既有抗体药物的精准靶向作用,又有小分子细胞毒药物的强力杀伤作用,相当于给破坏力很强的小分子装上了弹头,故而业界形象地将其比喻为“生物导弹”。 事实上,首个ADC药物Mylotarg早在2000年,就已经获得了FDA批准,用于治疗首次复发60岁以上CD33+不适合细胞毒化疗的急性髓性白血病(AML)患者。但是在验证性III期研究中发现,该药并未表现出明显的生存获益,而且还产生了严重的致命性肝损伤。在上市的10年后,辉瑞主动将其撤市。十几年来,ADC药物的研发一直处于低谷期。 直到2019年,FDA先后批准了3款ADC药物,才让曾经沉寂的ADC药物迎来了新的春天。而近日Immunomedics公司的sacituzumab govitecan,在III期临床试验中大放异彩,更是让ADC再一次走到了台前。 要知道,三阴性乳腺癌是乳腺癌中最难治的类型,它以雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体2(HER2)均为阴性表达得名,占乳腺癌患者的12%-20%。相较于其他类型的乳腺癌,三阴性乳腺在年轻女性中更常见,死亡率高,容易复发和转移,5年的生存率只有15%。而且对激素疗法和HER2靶向治疗都不敏感,除了近年获批的免疫疗法,只能选择化疗,但大部分患者很快会产生耐药性,且预后不佳。

Sacituzumab govitecan是一种新型、首创的抗体偶联药物(ADC),由靶向TROP-2抗原的人源化IgG1抗体与化疗药物伊立替康(拓扑异构酶I抑制剂)的代谢活性产物SN-38偶联而成。Trop-2抗体部分可以特异的结合到肿瘤细胞表面,而SN-38可以轻松毒死癌细胞。今年2月,FDA已经授予了sacituzumab govitecan突破性疗法认定。目前,FDA正在重新审评该药物的上市申请,预计将在今年6月做出回复。
从作用机理来看,TROP-2在多种肿瘤细胞(如:乳腺癌、宫颈癌、结直肠癌、肾癌、肝癌、肺癌、胰腺癌、前列腺癌等)中均大量表达。理论上,该药对各种实体瘤均有治疗潜力。事实上,除三阴性乳腺癌外,该药在非小细胞肺癌、尿路上皮癌的治疗上也获得了良好的临床试验数据。 近日,FDA还授予了sacituzumab govitecan快速审批通道,以治疗新辅助/辅助疗法中预先接受过PD-1 / PD-L1抑制剂且无论是否接受含铂化疗的局部进展或转移性尿路上皮癌患者。在2019年的欧洲肿瘤医学学会(ESMO)上,中期结果显示,在PD-1 / PD-L1抑制剂和含铂化疗后疾病进展的转移性尿路上皮癌患者中,sacituzumab govitecan的总体响应率为29%。 值得注意的是,2019年4月由康桥资本(C-Bridge Capital)投资建立的一家生物制药公司Everest Medicines,以高达8.35亿美元与Immunomedics公司达成了一项独家许可协议,获得了sacituzumab govitecan在大中华区、韩国及一些东南亚国家和地区的开发、注册和商业化权益。相信sacituzumab govitecan能够以更快的速度进入中国,惠及更多三阴性乳腺癌患者。 目前,FDA已经批准了7款ADC药物,今年年初我国更是迎来了首款ADC药物,此外还有众多中国企业正在进行ADC药物的研发。相信未来ADC药物一定会在肿瘤治疗领域,占有举足轻重的作用,惠及更多的肿瘤患者。
真固生物相关试剂盒产品
ONCO/RevealTM HRD 27 Gene Panel
· 一次性检测BRCA1/2和19个HRD相关基因以及6个肿瘤常见突变基因;
· 确保相邻扩增子之间都有重叠区域,可以完全覆盖目标区域;
· 配套自主开发的生物信息学分析软件PiVAT,可安装在云端或本地服务器上,一键分析,直接识别变异,简易易学;
· 单管内完成27个基因1069个扩增子建库,避免分管操作;
· 8小时内即可实现从DNA到上机测序,操作时间低至2小时;
· 适用于肿瘤组织和外周血,采样更灵活。
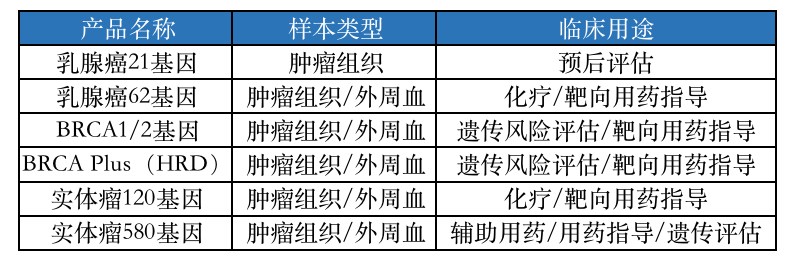
贞固医学相关临检服务项目
咨询沟通
销售咨询:付先生15000010042 销售咨询:韩先生18600112066 咨询邮箱:fubo@pillar-biosciences.com 关于真固生物



 021 - 6089 0178
021 - 6089 0178