重磅发布——全球首款中美欧三证齐全多癌种NGS伴随诊断试剂盒国内上市!
发布时间:2022-08-23 10:36:49 访问次数:
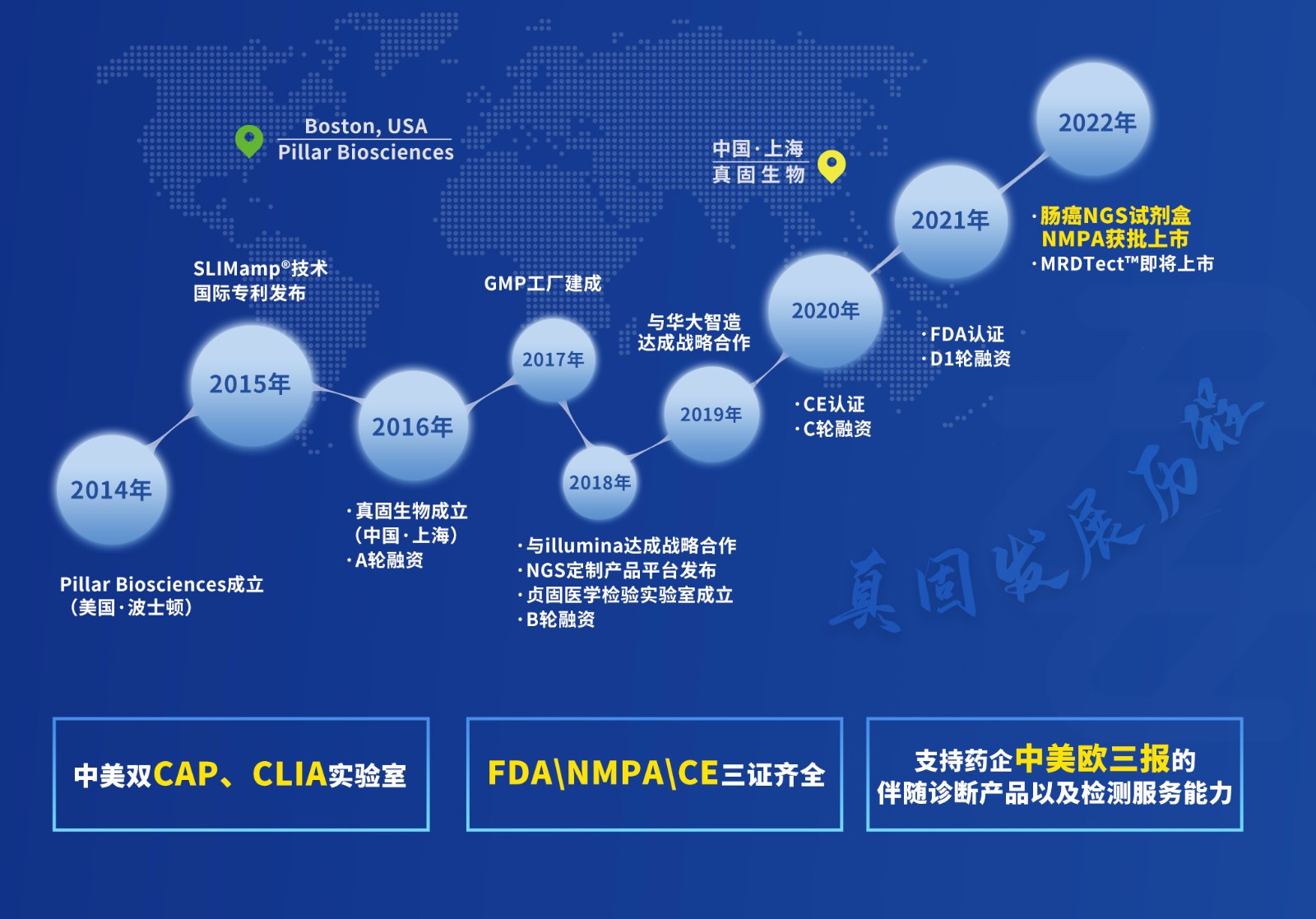
2022年8月17日,由上海真固生物科技有限公司研发的NGS多基因联合检测产品“人KRAS/BRAF/PIK3CA基因突变检测试剂盒(可逆末端终止测序法)”获得国家药品监督管理局(NMPA)三类医疗器械注册证(国械注准20223401107)。

此次NMPA批准的试剂盒为基于ILMN NGS测序平台的多基因位点伴随诊断产品,用于体外定性检测结直肠癌患者肿瘤样本中与靶向治疗密切相关的KRAS、BRAF和PIK3CA基因的多种突变状态,筛选适合接受靶向药物(西妥昔单抗)治疗的患者。
真固生物此款产品此前已获FDA&CE批准用于多癌种伴随诊断(肠癌&肺癌),从而成为全球首款于中美欧同时获批的多癌种NGS通用伴随诊断试剂盒。

(FDA认证公告)

(CE认证确认函)
真固生物作为全球领先的IVD级NGS产品服务供应商,拥有自主研发的SLIMamp®单管超高重靶向建库专利技术平台,一直聚焦于适合院内检测场景的IVD级多重扩增NGS技术产品的研发与应用,目前已与国内外超百家大中型检测机构合作,为后者提供多款IVD和LDT级别的NGS检测产品和服务。此次国内注册获批,也意味着真固生物同时拥有中美欧药物伴随诊断三报能力,在扩大院内临床检测应用和患者获益的同时,可以为药企提供靶向治疗新药全球伴随诊断产品及配套服务。
本次试剂盒临床验证过程历时近2年,与国内多家顶尖临床机构合作,累计完成1539例样本检测,也是目前市场上完成临床验证样本数量最多的结直肠癌NGS伴随诊断产品。
本次获批的多基因伴随诊断试剂盒最低检测下限可达0.6%,总体符合率高达98.98% ,伴随诊断总体符合率99.56%。另外,基于真固生物强大的自主研发能力,此款试剂盒所采用的SLIMamp®建库专利技术,仅需20ng样本起始量即可有效检出目标突变,从而帮助临床端节约宝贵的组织标本。
真固生物美国公司 CEO Randy Pritchard 表示:
此次获批的“清固®”多基因伴随诊断试剂盒迈出了真固生物在中国NGS伴随诊断市场的第一步,可以精准提供转移性结直肠癌患者KRAS突变的变异图谱。而对于中国各地的肿瘤专家来说,该款试剂盒可以很好地满足其更精简、更高效、更准确的诊断需求,从而为患者提供广泛而快速的检测结果及最佳治疗方案,同时能够显著减少启动治疗的等待时间,使每一名患者更有信心地面对他们的治疗旅程。
真固生物联合创始人兼CEO 王强 博士表示:
“清固®”NGS多基因伴随诊断试剂盒的获批上市,意味着肿瘤NGS院内检测新时代的到来。真固生物独有的单管、一键、超高重NGS检测技术产品,以及简单高效低成本且易于自动化的运行逻辑,可以极低的门槛在任何有资质的院内实验室迅速应用。有效提高精准诊断可及性,扩大患者获益。
据悉,真固生物布局的多个NGS检测产品正陆续进入IVD管线的不同阶段,随着更多NGS精准检测产品的推出,真固生物将与更多药企、医院同道一起,进一步推动精准诊疗触手可及,实现精准医疗大众化。

 021 - 6089 0178
021 - 6089 0178